Durante il recente congresso nazionale di SIN (Società Italiana di Nefrologia) il Prof. Grandaliano ha presentato interessanti concetti sul ruolo della membrana dialitica nei pazienti con malattia renale cronica (CKD), in particolare nei pazienti candidati al trapianto di rene e nei soggetti che abbiano sviluppato DGF (Delayed Graft Function) a seguito di trapianto. Inoltre, interessanti e promettenti risultati sono stati presentati in merito all’utilizzo della membrana dialitica PMMA nei pazienti emodializzati affetti da COVID-19.
Download PdfPaziente CKD e candidato al trapianto: immunomodulazione e ruolo della membrana dialitica
Caratteristiche immunologiche dei pazienti emodializzati
La durata del periodo di dialisi pre-trapianto nei pazienti elegibili a trapianto di rene è correlata a conseguente perdita prematura del graft e anche a ad aumento di mortalità (1). Quando i pazienti con insufficienza renale cronica iniziano terapia sostitutiva renale con l’emodialisi, il loro profilo immunitario cambia rispetto a quello dei pazienti con CKD non ancora emodializzati, con alterazione dell’espressione dei geni coinvolti nei patterns di risposta immunitaria (2). I pazienti sottoposti a emodialisi hanno una risposta immunitaria compromessa che sembra peggiorare progressivamente con la durata del periodo di terapia sostitutiva renale (3). Fondamentale in questo aspetto è l’emocompatibilità e la biocompatibilità della membrana di dialisi. Infatti, il contatto sangue-membrana influenza inevitabilmente sia l’immunità innata sia quella adattativa (3). I linfociti T sono i principali mediatori dell’immunità adattativa ed è stato dimostrato come possano subire alterazioni in base alle diverse modalità dialitiche (4). L’equilibrio tra le cellule T regolatorie (Treg) e le cellule T helper (Th) 17 svolge un ruolo importante nello sviluppo di malattie infiammatorie e autoimmuni nei pazienti in emodialisi. L’equilibrio Treg / Th17 è alterato dall’uremia, specialmente nei pazienti in cui poi si sviluppano eventi cardiovascolari avversi. Questo disequilibrio Th17 / Treg potrebbe agire sinergicamente al processo di microinfiammazione nello sviluppo di aterosclerosi immuno-mediata e contribuire conseguentemente all’elevata incidenza di eventi cardiovascolari avversi (5, 6).
Delayed Graft Function e sopravvivenza dell’allotrapianto
La DGF dipende sicuramente dal tipo di donatore e la sua incidenza nel ricevente può variare dal 10 al 40%. La DGF influenza negativamente la sopravvivenza del graft. I pazienti che sviluppano DGF hanno una concentrazione inferiore di Treg al momento del trapianto rispetto a quelli che recuperano la piena funzionalità renale a seguito di trapianto renale (7). I pazienti con DGF mostrano un aumento significativo delle cellule Th17 circolanti dopo il trapianto (8). La DGF è accentuata nei pazienti che presentano infiltrazione interstiziale di cellule Th17 nel graft (9). I livelli plasmatici di IL-6 sono associati alla concentrazione di cellule Th17 e Treg circolanti (5). È dimostrato come il danno da ischemia-riperfusione generato dall’attivazione del sistema del complemento e dalla cascata coagulativa sia una causa principale di sviluppo di DGF (10).
PMMA – dall’inattivazione del sistema del Complemento alla dialisi tridimensionale
La membrana da dialisi in polimetilmetacrilato (PMMA) oltre alla sua eccezionale emocompatibilità e biocompatibilità (ridotta attivazione del sistema del complemento, ridotta attivazione della cascata coagulativo-infiammatoria dell’ospite) ha la proprietà di aggiungere una terza dimensione alla dialisi: l’adsorbimento. Mentre la diffusione e la convezione rimuovono molecole di piccole e medie dimensioni, l’adsorbimento ha la capacità di rimuovere molecole di medio ed alto peso molecolare non filtrabili responsabili di molte complicazioni nel paziente con CKD. La biocompatibilità della membrana è un aspetto fondamentale e il trattamento emodialitico con membrana in PMMA ha dimostrato essere in grado di ridurre i livelli circolanti di mediatori pro-infiammatori inclusa IL-6 (11, 12).
Il 40% dei pazienti in attesa di trapianto di rene presenta anticorpi anti-HLA circolanti, aumentando la probabilità di rigetto mediato da anticorpi, la principale causa di perdita del graft. Inoltre, i pazienti con rigetto mediato da anticorpi hanno un’aumentata espressione genica delle proteine coinvolte nella via di segnalazione di IFN-α (13). Il contatto sangue-membrana induce una iperproduzione di IFN-α (14). Emodialisi con PMMA si è dimostrata efficace nella sua rimozione (15), consentendo così di intervenire nei meccanismi alla base del rigetto anticorpo-mediato. La concentrazione della proteina MxA, la cui funzione è strettamente dipendente dalla concentrazione di IFN-α, si riduce notevolmente nel momento in cui il paziente emodializza con membrana PMMA rispetto a membrana in Polisulfone (PS).
PMMA – aggiungere una quarta dimensione alla dialisi
La nuova generazione di membrane in PMMA aggiunge inoltre una quarta dimensione alla dialisi: l’antitrombogenicità. L’emodialisi induce quasi sempre un deposito di piastrine e fibrina lungo le fibre dovuto all’attivazione della cascata coagulativa (16). I fattori della coagulazione intervengono nel processo infiammatorio e nella generazione di clotting del filtro o del vaso e sono in grado di interagire con specifici recettori di membrana modulando così la risposta immunitaria. La nuova serie di PMMA, Filtryzer® NF, è in grado di ridurre al minimo l’adesione di piastrine e di fibrinogeno sulla superficie del filtro e riduce il rilascio di tromboglobulina prodotta dalle piastrine una volta formato il trombo (17).
La membrana in PMMA è nota per la sua eccellente emocompatibilità. Diversi studi hanno dimostrato che l’emodialisi condotta con membrana in PMMA riduce l’espressione dei fattori del complemento C3a – C5a e mediatori della risposta infiammatoria come IL-6, IL-8, TNF-α e MCP-1 (11). È stato dimostrato che attenuando l’attivazione del processo coagulativo durante la sessione di dialisi utilizzando filtri specifici, i linfomonociti circolanti riducono l’espressione di CCR-2, recettore per MCP-1, una proteina chemiotattica per i monociti (18).
Nei pazienti che sviluppano DGF, si riscontra un’alta concentrazione di CCR-2 sui linfomonociti circolanti prima del trapianto. Tra le altre cose, il Graft, soprattutto quando proviene da un donatore cerebralmente morto, è caratterizzato da una ingente produzione di MCP-1 (19). Alti livelli di MCP-1 rilasciati dal rene provocano una maggiore espressione di CCR-2, con un conseguente maggiore reclutamento di cellule infiammatorie. Una membrana che riduce l’attivazione della coagulazione permette quindi di attenuare questo fenomeno.
COVID-19 ed il ruolo della membrana dialitica nei pazienti HD
Alcune delle manifestazioni cliniche più significative di SARS-CoV-2 sono legate all’attivazione del sistema del complemento, attivazione della cascata infiammatoria con una risposta dell’ospite disregolata che può portare in alcuni casi al rilascio di quantità rilevanti di mediatori infiammatori incluse le citochine. Utilizzare quindi una membrana in grado di ridurre al minimo l’attivazione del sistema del complemento, la risposta pro-infiammatoria e inoltre capace di rimuovere citochine durante il trattamento di emodialisi, appare razionale, logico e può essere una strategia efficace, giacché quel paziente deve comunque ricevere trattamento sostitutivo renale.
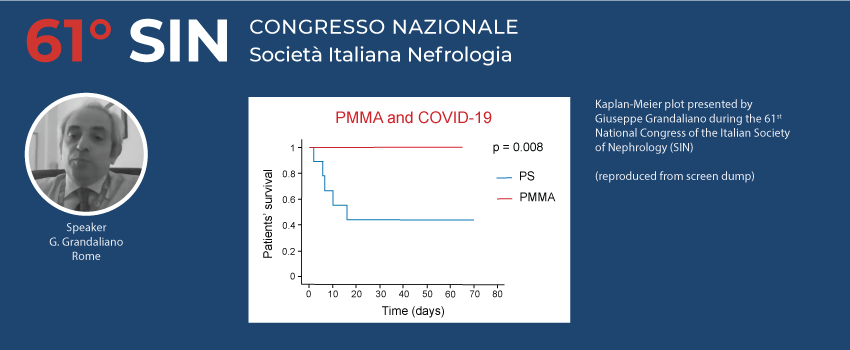
I dati di 24 pazienti emodializzati con COVID-19 provenienti da quattro centri ospedalieri in Italia sono stati analizzati retrospettivamente (emodialisi con PMMA vs PS). Questi risultati preliminari mostrano come i pazienti emodializzati con membrana PMMA hanno una sopravvivenza significativamente maggiore rispetto ai pazienti che hanno ricevuto emodialisi con membrana PS.
Considerando la vaccinazione per SARS-CoV-2, quando sarà disponibile, è importante ricordare l’importanza della risposta immunitaria al vaccino del paziente emodializzato. I pazienti in emodialisi cronica hanno una risposta vaccinale notevolmente ridotta a causa del loro stato di immunocompromissione.
Negli anni scorsi, è stato dimostrato come l’utilizzo di membrana PMMA in pazienti emodializzati in precedenza Non-Responder al vaccino per epatite B, aumenta significativamente il titolo anticorpale e quindi la risposta del paziente alla vaccinazione (20), determinata dalla riduzione della concentrazione ematica della glicoproteina sCD40, proteina implicata nello sviluppo del titolo anticorpale, di peso molecolare di circa 180 kDa, efficacemente rimossa da PMMA (21).
Garantire una maggiore protezione ai pazienti emodializzati, cercando una migliore risposta al vaccino antinfluenzale stagionale, dovrebbe essere un target clinico in generale e soprattutto nell’era COVID-19.
Questi effetti dati dalla membrana PMMA sul sistema immunitario dei pazienti in emodialisi possono spiegare il razionale dei risultati di studi che hanno mostrano una riduzione di mortalità long-term nella popolazione emodializzata con PMMA rispetto a quelle che hanno ricevuto emodialisi con altre membrane dialitiche (22).
Il webinar può essere visto on-demand dai partecipanti registrati sul website del congresso.
Clicca qui per vedere il contenuto.
Riferimenti
1. Haller MC, Kainz A, Baer H, Oberbauer R. Dialysis Vintage and Outcomes after Kidney Transplantation: A Retrospective Cohort Study. Clinical journal of the American Society of Nephrology : CJASN. 2017;12(1):122-30.
2. Zaza G, Granata S, Rascio F, Pontrelli P, Dell’Oglio MP, Cox SN, et al. A specific immune transcriptomic profile discriminates chronic kidney disease patients in predialysis from hemodialyzed patients. BMC Med Genomics. 2013b;6:17.
3. Donati D, Degiannis D, Combates N, Raskova J, Raska K, Jr. Effects of hemodialysis on activation of lymphocytes: analysis by an in vitro dialysis model. Journal of the American Society of Nephrology : JASN. 1992;2(10):1490-7.
4. Xiaoyan J, Rongyi C, Xuesen C, Jianzhou Z, Jun J, Xiaoqiang D, et al. The difference of T cell phenotypes in end stage renal disease patients under different dialysis modality. BMC nephrology. 2019;20(1):301.
5. Zhang J, Hua G, Zhang X, Tong R, Du X, Li Z. Regulatory T cells/T-helper cell 17 functional imbalance in uraemic patients on maintenance haemodialysis: a pivotal link between microinflammation and adverse cardiovascular events. Nephrology (Carlton, Vic). 2010;15(1):33-41.
6. Afzali B, Edozie FC, Fazekasova H, Scottà C, Mitchell PJ, Canavan JB, et al. Comparison of regulatory T cells in hemodialysis patients and healthy controls: implications for cell therapy in transplantation. Clinical journal of the American Society of Nephrology : CJASN. 2013;8(8):1396-405.
7. Nguyen MT, Fryml E, Sahakian SK, Liu S, Cantarovich M, Lipman M, et al. Pretransplant Recipient Circulating CD4+CD127lo/- Tumor Necrosis Factor Receptor 2+ Regulatory T Cells: A Surrogate of Regulatory T Cell-Suppressive Function and Predictor of Delayed and Slow Graft Function After Kidney Transplantation. Transplantation. 2016;100(2):314-24.
8. Loverre A, Divella C, Castellano G, Tataranni T, Zaza G, Rossini M, et al. T helper 1, 2 and 17 cell subsets in renal transplant patients with delayed graft function. Transpl Int. 2011;24(3):233-42.
9. Deteix C, Attuil-Audenis V, Duthey A, Patey N, McGregor B, Dubois V, et al. Intragraft Th17 infiltrate promotes lymphoid neogenesis and hastens clinical chronic rejection. Journal of immunology (Baltimore, Md : 1950). 2010;184(9):5344-51.
10. Pontrelli P, Cariello M, Rascio F, Gigante M, Verrienti R, Tataranni T, et al. Thrombin may modulate dendritic cell activation in kidney transplant recipients with delayed graft function. Nephrology, dialysis, transplantation : official publication of the European Dialysis and Transplant Association – European Renal Association. 2015;30(9):1480-7.
11. Pertosa G, Grandaliano G, Gesualdo L, Ranieri E, Monno R, Schena FP. Interleukin-6, interleukin-8 and monocyte chemotactic peptide-1 gene expression and protein synthesis are independently modulated by hemodialysis membranes. Kidney international. 1998;54(2):570-9.
12. Galli F, Benedetti S, Floridi A, Canestrari F, Piroddi M, Buoncristiani E, et al. Glycoxidation and inflammatory markers in patients on treatment with PMMA-based protein-leaking dialyzers. Kidney international. 2005;67(2):750-9.
13. Rascio F, Pontrelli P, Accetturo M, Oranger A, Gigante M, Castellano G, et al. A type I interferon signature characterizes chronic antibody-mediated rejection in kidney transplantation. J Pathol. 2015;237(1):72-84.
14. Badalamenti S, Catania A, Lunghi G, Covini G, Bredi E, Brancaccio D, et al. Changes in viremia and circulating interferon-alpha during hemodialysis in hepatitis C virus-positive patients: only coincidental phenomena? American journal of kidney diseases : the official journal of the National Kidney Foundation. 2003;42(1):143-50.
15. Barril G, Quiroga JA, Sanz P, Rodrìguez-Salvanés F, Selgas R, Carreño V. Pegylated interferon-alpha2a kinetics during experimental haemodialysis: impact of permeability and pore size of dialysers. Alimentary pharmacology & therapeutics. 2004;20(1):37-44.
16. Hofbauer R, Moser D, Frass M, Oberbauer R, Kaye AD, Wagner O, et al. Effect of anticoagulation on blood membrane interactions during hemodialysis. Kidney international. 1999;56(4):1578-83.
17. Masakane I, Esashi S, Yoshida A, Chida T, Fujieda H, Ueno Y, et al. A new polymethylmetacrylate membrane improves the membrane adhesion of blood components and clinical efficacy. Renal Replacement Therapy. 2017;3(1):32.
18. Pertosa G, Simone S, Soccio M, Marrone D, Gesualdo L, Schena FP, et al. Coagulation cascade activation causes CC chemokine receptor-2 gene expression and mononuclear cell activation in hemodialysis patients. Journal of the American Society of Nephrology: JASN. 2005;16(8):2477-86.
19. de Vries DK, Lindeman JH, Ringers J, Reinders ME, Rabelink TJ, Schaapherder AF. Donor brain death predisposes human kidney grafts to a proinflammatory reaction after transplantation. American journal of transplantation : official journal of the American Society of Transplantation and the American Society of Transplant Surgeons. 2011;11(5):1064-70.
20. Contin-Bordes C, Lacraz A, Precigout V. Potential role of the soluble form of CD40 in deficient immunological function of dialysis patients: new findings of its amelioration using polymethylmethacrylate (PMMA) membrane. NDT Plus. 2010;3 [Suppl 1]:i20-i7.
21. Contin C, Pitard V, Delmas Y, Pelletier N, Defrance T, Moreau JF, et al. Potential role of soluble CD40 in the humoral immune response impairment of uraemic patients. Immunology. 2003b;110(1):131-40.
22. Abe M, Hamano T, Wada A, Nakai S, Masakane I. Effect of dialyzer membrane materials on survival in chronic hemodialysis patients: Results from the annual survey of the Japanese Nationwide Dialysis Registry. PloS one. 2017a;12(9):e0184424.