Toraymyxin® è stato utilizzato per il trattamento di pazienti COVID-19 gravi in Europa, Russia, Asia e negli Stati Uniti.
Toraymyxin® è stato autorizzato da US FDA come Investigational Device Exemption (IDE) per trattamento di pazienti COVID-19 in shock settico e alto livello di endotossinemia (EAA™ = 0,6-0,9).
Toraymyxin® è stato autorizzato da Health Canada per trattamento di pazienti COVID-19 con gravi forme di ARF.
Polymyxin B Hemoperfusion therapy (Toraymyxin®):
- Neutralizzazione diretta di endotossina [1, 2]
- Aferesi diretta di cellule immunitarie [3, 4]
- Ripristino corretto Balance Immunitario [5]
- Miglioramento funzione polmonare [6, 7]
- Rapido recupero dell’emodinamica [7, 8]
Aspetti di fisiopatologia nei pazienti COVID-19
I pazienti con infezione SARS-CoV-2 possono sviluppare stati di malattia lieve, moderata o grave; quest’ultima condizione può comprendere forme di polmoniti gravi, Acute Respiratory Failure (ARF), Acute Kidney Injury (AKI), danno endoteliale, coagulopatia, sepsi o shock settico [9-11].
La polmonite è la complicazione più frequente nei pazienti COVID-19. Nei casi più gravi, questa può essere accompagnata da una risposta immunitaria disregolata. E’ riconosciuto come i neutrofili abbiano un ruolo determinante nel generare questa risposta [12] e il “rolling” dei neutrofili è uno dei fattori chiave che comporta l’iper-produzione di citochine [13].
Nonostante sia riconosciuto come i Coronavirus possano essere classificati come patogeni respiratori, essi hanno un’abilità nell’attraversare barriere, penetrando e alterando altri organi e sistemi [14].
Fino al 60% dei pazienti COVID-19 manifestano sintomi gastrointestinali all’ammissione o sviluppati durante il ricovero ospedalierio, così come l’RNA virale è stato identificato nelle feci nel 48% di questi pazienti [15].
Pazienti con lunghi periodi di ricovero in terapia intensiva sono più soggetti a infezioni concomitanti [16]. Le infezioni da batteri gram-negativo così come la traslocazione diretta dalla mucosa intestinale conducono alla circolazione di endotossina a livello sistemico (Endotossinemia) [17].
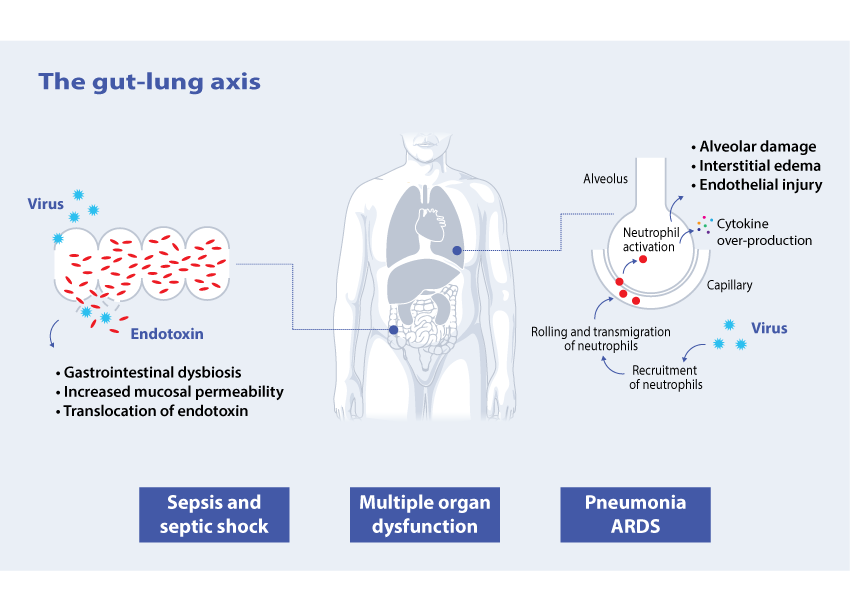
Polymyxin B Hemoperfusion nei pazienti COVID-19 gravi
Sulla base delle conoscenze attuali di fisiopatologia nel paziente COVID-19 e nel contesto di altre infezioni virali simili, è razionale pensare ad un potenziale ruolo di Polymyxin B Hemoperfusion (PMX-HP) (medical device Toraymyxin®) come terapia addizionale nei pazienti COVID-19 non-responsivi.
Toraymyxin® è stato utilizzato positivamente per il trattamento di pazienti durante altre pandemie virali incluse l’influenza aviaria (H5N1) e suina (H1N1), patologie caratterizzate da importanti insufficienze respiratorie acute [18-20].
In precedenti pubblicazioni disponibili, l’utilizzo di Toraymyxin® nei pazienti con infezione virale ha mostrato un miglioramento della funzione polmonare e del quadro radiologico oltre a un miglior successo nello svezzamento dalla ventilazione meccanica [18-20]. Approfondisci
L’effetto positivo di PMX-HP nel contesto clinico di ALI/ARDS caratterizzati da grave edema interstiziale e alveolare, importante quantità di infiltrazione di neutrofili che conducono ad una aumentata permeabilità vascolare e alla compromissione dello scambio gassoso nei pazienti, è ben consolidato.
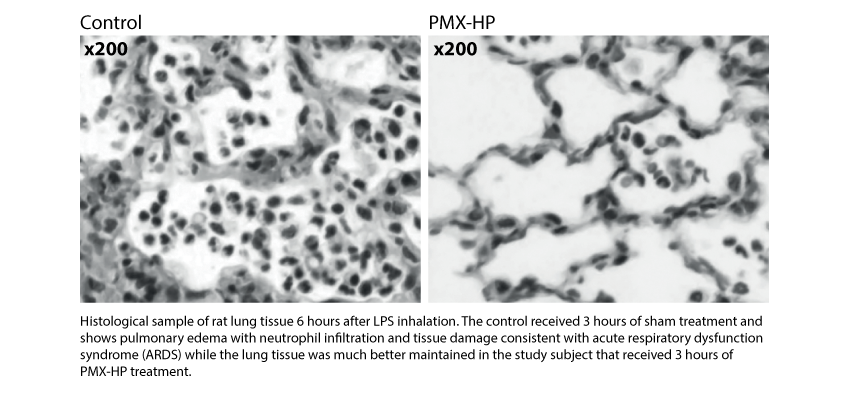
In uno studio su animale che ha considerato l’analisi istologica di tessuto polmononare di topi, è stato dimostrato che il trattamento di PMX-HP sopprime l’infiltrazione di neutrofili migliorando la microcircolazione polmonare [21] (vedi la figura sotto). Questo è consistente con le ulteriori pubblicazioni che mostrano l’azione di aferesi dei neutrofili attivati data da PMX-HP.
Kushi et al. [6] hanno studiato l’effetto della terapia di PMX-HP in 36 pazienti settici con quadro clinico complicato da ARDS. I ricercatori hanno esaminato la possibile correlazione tra IL-8, Elastasi Neutrofila (NE – indice di attivazione dei neutrofili), PAI-1 (Plasminogen Activator Inhibitor – indice di attivazione endoteliale vascolare) e l’ossigenazione polmonare (PaO2/FiO2). A un mese di distanza dal trattamento di PMX-HP tutti i pazienti erano sopravvissuti con miglioramento significativo del rapporto PaO2/FiO2 (244 ± 26,3 to 352 ± 25,4, p < 0,05). I livelli di IL-8, NE, PAI-1 sono tutti diminuiti in modo significativo. I miglioramenti di ossigenazione polmonare sono sembrati essere correlati alla diminuizione dei livelli di NE e IL-8.
Inoltre, diversi studi hanno valutato l’utilizzo di PMX-HP nei pazienti con malattie polmonari insterstiziali.
Uno studio pilota su 16 pazienti disegnato per valutare il meccanismo di PMX-HP nei pazienti affetti da fibrosi polmonare con eventi di riacutizzazione, ha dimostrato la capacità di PMX-HP di adsorbire neutrofili attivati [3].
In un successivo studio su 160 pazienti affetti da polmonite interstiziale hanno ricevuto PMX-HP per due giorni consecutivi.
Il rapporto PaO2/FiO2 è migliorato significativamente dal termine della seconda sessione di PMX-HP (173,9 ± 105,4 to195,2 ± 106,8, p = 0,003) e la conta dei leucociti è significativamente diminuita (13.330 ± 7.002 to 9.426±5.188/mm3, p < 0,001). Inoltre, il tasso di sopravvivenza a 30 giorni registratato è stato di 70.1% [23].
Riferimenti
- Tani, T., et al., Extracorporeal removal of endotoxin: the polymyxin B-immobilized fiber cartridge. Contrib Nephrol, 2010. 167: p. 35-44. (Pubmed)
- Yamashita, C., et al., In Vitro Study of Endotoxin Adsorption by a Polymyxin B-Immobilized Fiber Column. Blood Purif, 2018. 46(4): p. 269-273. (Pubmed)
- Abe, S., et al., Neutrophil adsorption by polymyxin B-immobilized fiber column for acute exacerbation in patients with interstitial pneumonia: a pilot study. Blood Purif, 2010. 29(4): p. 321-6. (Pubmed)
- Nishibori, M., et al., Specific Removal of Monocytes from Peripheral Blood of Septic Patients by Polymyxin B-immobilized Filter Column. Acta Med Okayama, 2009. 63(1): p. 65-9. (Pubmed)
- Esteban, E., et al., Immunomodulation in sepsis: the role of endotoxin removal by polymyxin B-immobilized cartridge. Mediators Inflamm, 2013. 2013: p. 507539. (Pubmed)
- Kushi, H., et al., Early hemoperfusion with an immobilized polymyxin B fiber column eliminates humoral mediators and improves pulmonary oxygenation. Crit Care, 2005a. 9(6): p. R653-61. (Pubmed)
- Klein, D.J., et al., Polymyxin B hemoperfusion in endotoxemic septic shock patients without extreme endotoxemia: a post hoc analysis of the EUPHRATES trial. Intensive Care Med, 2018. (Pubmed)
- Cruz, D.N., et al., Early use of polymyxin B hemoperfusion in abdominal septic shock: the EUPHAS randomized controlled trial. Jama, 2009. 301(23): p. 2445-52. (Pubmed)
- Fanelli, V., et al., Acute kidney injury in SARS-CoV-2 infected patients. Crit Care, 2020. 24(1): p. 155. (Pubmed)
- Huang, C., et al., Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. Lancet, 2020. 395(10223): p. 497-506. (Pubmed)
- Klok, F.A., et al., Incidence of thrombotic complications in critically ill ICU patients with COVID-19. Thromb Res, 2020. (Pubmed)
- Bordon, J., et al., Understanding the roles of cytokines and neutrophil activity and neutrophil apoptosis in the protective versus deleterious inflammatory response in pneumonia. Int J Infect Dis, 2013. 17(2): p. e76-83. (Pubmed)
- Grommes, J. and O. Soehnlein, Contribution of neutrophils to acute lung injury. Mol Med, 2011. 17(3-4): p. 293-307. (Pubmed)
- Openshaw, P.J., Crossing barriers: infections of the lung and the gut. Mucosal Immunol, 2009. 2(2): p. 100-2. (Pubmed)
- Lin, L., et al., Gastrointestinal symptoms of 95 cases with SARS-CoV-2 infection. Gut, 2020. 69(6): p. 997-1001. (Pubmed)
- Ronco, C. and T. Reis, Kidney involvement in COVID-19 and rationale for extracorporeal therapies. Nat Rev Nephrol, 2020. (Pubmed)
- Fink, M.P. and R.L. Delude, Epithelial barrier dysfunction: a unifying theme to explain the pathogenesis of multiple organ dysfunction at the cellular level. Crit Care Clin, 2005. 21(2): p. 177-96. (Pubmed)
- Binh, N.G., et al., Polymyxin-B-immobilized-fiber column hemoperfusion with oseltamivir treatment for ARDS due to influenza H1N1/09. Respirol Case Rep, 2015. 3(2): p. 57-60. (Pubmed)
- Kudo, K., et al., Clinical preparedness for severe pneumonia with highly pathogenic avian influenza A (H5N1): experiences with cases in Vietnam. Respir Investig, 2012. 50(4): p. 140-50. (Pubmed)
- Araki, T., H. Ogawa, and A. Nakashima, Endotoxin adsorption therapy for a patient with severe pneumonia resulting from novel influenza A (H1N1) virus infection. Therapeutic apheresis and dialysis : official peer-reviewed journal of the International Society for Apheresis, the Japanese Society for Apheresis, the Japanese Society for Dialysis Therapy, 2011. 15(2): p. 207-208. (Pubmed)
- Iba, T., et al., Effect of hemoperfusion using polymyxin B-immobilized fibers on acute lung injury in a rat sepsis model. Int J Med Sci, 2014. 11(3): p. 255-61. (Pubmed)
- Kumagai, T., et al., Apheresis of activated leukocytes with an immobilized polymyxin B filter in patients with septic shock. Shock, 2010. 34(5): p. 461-6. (Pubmed)
- Cruz, D.N., et al., Early use of polymyxin B hemoperfusion in abdominal septic shock: the EUPHAS randomized controlled trial. Jama, 2009. 301(23): p. 2445-52. (Pubmed)